
Leitfaden zur Messung des pH-Werts von Lebensmitteln

Chemischer Sauerstoffbedarf CSB – photometrisch bestimmt

Die CAL Check- Funktion für Photometer richtig nutzen

Die Gro Line-Serie

Honigsorten anhand ihrer Leitfähigkeit unterscheiden
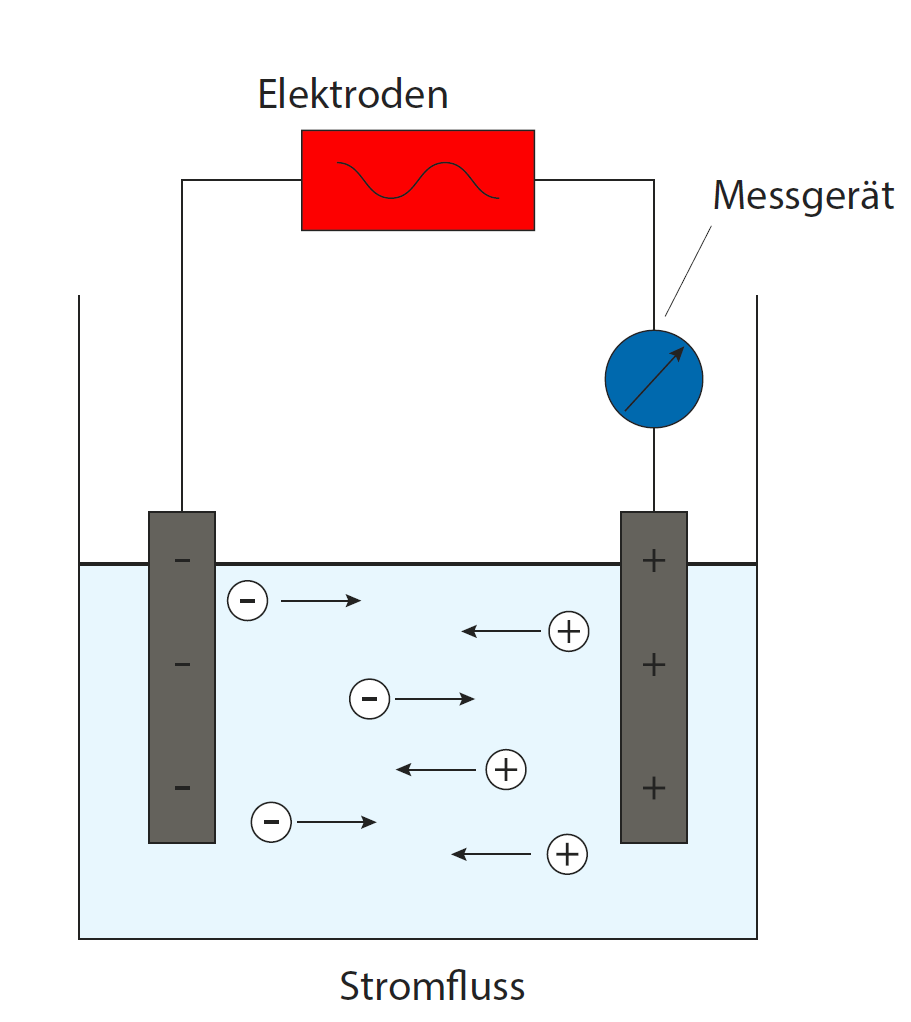
Leitfähigkeit erklärt

Leitfähigkeitsmessung, -kalibrierung und Elektrodenpflege

pH in Fleisch sicher und professionell messen

Warum sind die vielen Lösungen bei der pH-Messung wichtig?

Bedarfsgerechte Umweltanalytik dank moderner Photometer

Das erste Spektralphotometer von Hanna Instruments

Den pH-Wert in Wein und Maische messen

Den pH-Wert von Lebensmitteln messen

Den Säuregehalt in Fruchtsaft bestimmen

Der GroLine®-Monitor für pH und Leitfähigkeit

Der pH-Wert von Mascara

Die Bedeutung des pH-Werts bei der Käseproduktion
Die neuen Foodcare Thermometer von Hanna Instruments

Die richtige Wassertemperatur zum Kaffee brühen

HI833xx Multiparameter-Photometer mit pH-Meter

Interessantes rund um die Zuckergehaltmessung in Traubenmost

Neue HALO®-pH-Elektroden in Hannas Sortiment

Professionelle Messtechnik in den Einsatzfeldern Trinkwasser, Hydrogeologie und Limnologie

Redoxpotential messen

Refraktometrie

Temperaturmessung und Thermometer
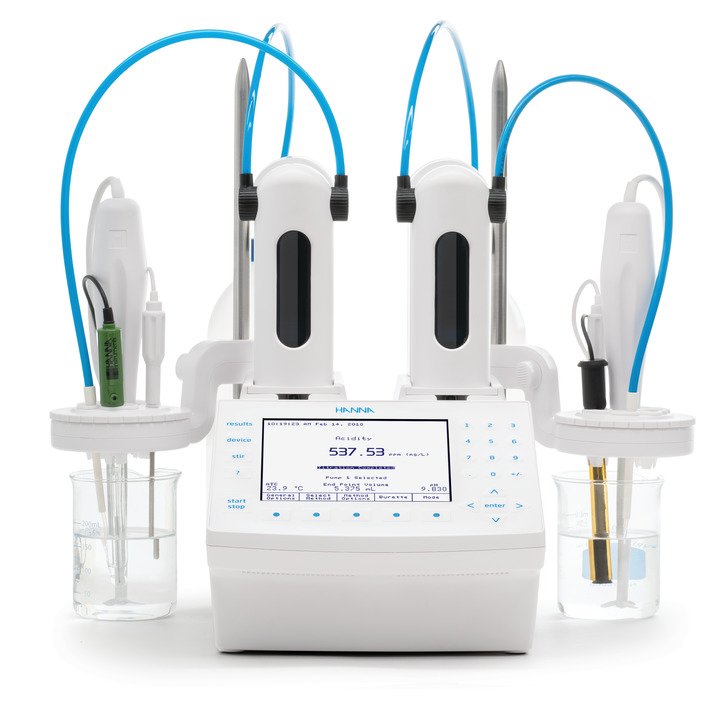
Titrimetrische Calcium-Bestimmung mit der ionenselektiven Elektrode

Was hat die Hygiene in Schwimmbädern mit dem Redoxpotential gemein?

Alkalinität im Meerwasseraquarium / Riffaquarium messen

Calcium – ein wichtiges Element im Riffaquarium

Die Wassertemperatur im Aquarium

Fehler bei der Leitfähigkeitsmessung

Hanna Combo
Hannas Foodcare pH-Meter

pH-Messung in nichtwässrigen oder teilwässrigen Medien

Photometrische Messungen für Meerwasseraquaristik

Praktische Redoxpotentialmessung - Teil 1, chemische Vorbehandlung

Praktische Redoxpotentialmessung - Teil 2, Umgang mit der Elektrode

Warum ist es wichtig, den pH-Wert in Aquarienwasser zu messen?

Wussten Sie, dass der pH-Wert auch beim Backen von Keksen wichtig ist?

Acht Hinweise, um das Beste aus Ihrem Checker® HC herauszuholen

Die CAL Check-Funktion
Die Messung der Gesamthärte

Die richtige pH-Kalibrierlösung finden

Ein Hydroponik-Monitor auf Abwegen

Gesamtammonium im Aquarium
Grundlagen der Spektralphotometrie

Nitrit im Salzwasseraquarium bestimmen

Phosphor im Riffaquarium messen

Unsere Pool Line - eine kleine Kaufberatung
pH-Wert und pH-Elektrode – etwas Theorie

Abgeleitete Parameter der Leitfähigkeit

Aufschlämmung für die pH/Leitfähigkeitsmessung von Boden herstellen

Messgeräte ohne pH-Elektroden verfügbar

Wasserwerte in Heizungswasser bestimmen

Analytik ist nicht Ihr Bier?

Das Messen des Säuregehalts in natürlichen Gewässern

Den Gehalt an Nitrationen mit der ISE messen

Den Reifegrad von Tomaten bestimmen
Den Wassergehalt von Biodiesel bestimmen

Der neue HI98319 Salinitätstester von Hanna Instruments

Die Analyse von Met

Die Leitfähigkeit von Boden bestimmen

Die neue HI97xxx-Serie

Gelöster Sauerstoff – Anwendungen und Messmöglichkeiten

HI935012 – Ein Thermistor-Thermometer für Brauprozesse

HI98198 opdo - Unsere Messgeräte-Serie bekommt Zuwachs

HI99xxxx-Serie in neuem Design
Küvetten richtig für die Trübungsmessung vorbereiten

Neue Messgeräte in der HI9816x-Serie
Neue Tester von Hanna Instruments
Neue Titrationssysteme HI931 - HI932C1 – HI932C2

Salinität in Meerwasseraquarien messen

Tipps & Tricks zu photometrischen Messungen

Trübungsmessung bei der Zuckerherstellung

Warum es wichtig ist, den Gesamtgehalt gelöster Feststoffe in Kaffee zu bestimmen

Was ist eigentlich gelöster Sauerstoff?

Bestimmung von pH-Wert und titrierbarer Säure in Sauerteig

Das HI98199 ergänzt die Serie an Outdoor-Messtechnik perfekt

Den Brechungsindex von Marmelade, Konfitüre und Co. messen

Den pH-Wert des Bodens bestimmen
Der HI981037 pH-Tester für Messung direkt auf Haut

Der pH-Wert in Joghurt

Der pH-Wert in Milch

Der pH-Wert von Käse

Die Luftfeuchtigkeit - ein wichtiger Faktor für unser Wohlbefinden

Gelöste Sauerstoffmessung – Worin liegen die Vorteile eines optischen Systems gegenüber einem galvanischen System?

HI10532 HALO® Bluetooth-pH-Elektrode für Lebensmittel

HI144 / HI144-10 Temperatur-Logger
![HI151-x[xx] Pocket Thermometer Checktemp® 4](https://hannainst.ch/media/a4/2a/48/1681390725/HI151_Gruppenbild.jpg?ts=1681390725)
HI151-x[xx] Pocket Thermometer Checktemp® 4

HI713 oder HI736 Phosphor, Phosphat – ja was denn nun? Hier erklären wir Ihnen, wann Sie was in Ihrem Riffaquarium messen sollten

HI774 Checker® HC für Phosphat (ultra niedriger Bereich), speziell für Meerwasser

Inhaltsstoffe in Trinkwasser – Calcium- und Magnesiumkarbonat

Kennen Sie eigentlich schon unsere Schutzhüllen für Ihre Messgeräte?

Kolostrumqualität bei Mutterkühen überprüfen

Ostafrika-Buntbarsche – die Spezialisten unter den Aquarienfischen

Temperaturmessung bei der Lebensmittel- und Getränkeherstellung

Tipps & Tricks zu Messungen mit Ihrem Salinitätstester HI98319
Warum kann es sinnvoll sein eine Wasserprobe in der Photometrie vor der Messung zu filtrieren?

Das Textil-Diaphragma bei pH-Elektroden

Der HI981421 GroLine® -Monitor für die Hydroponik mit Inline-Sonde
Drahtlos messen mit der Hanna Lab App

HI148-x Thermologger

Salz- und Säureanalysen in Lebensmitteln
Tipps zur Verwendung von Mini-Hubkolbenpipetten (Analysenpipetten)

Wichtige Wasserwerte für Aquarien und womit Sie sie messen können

Chemische Parameter von Fischgewässern

Der pH-Wert bei der Reinigung von Wolle und anderen tierischen Fasern

Die Alkalinität - ein wichtiger Wasserparameter

Die Bedeutung von pH-Wert und Leitfähigkeit bei der Pflanzenbewässerung und Fertigation

Die Bestimmung des pH-Wertes in Wein

Die pH-Wert-Messung in Sushi-Reis

HI90060X-Serie Photometrische Elektroden
HI922 - Hannas automatischer Titrationsprobenwechsler
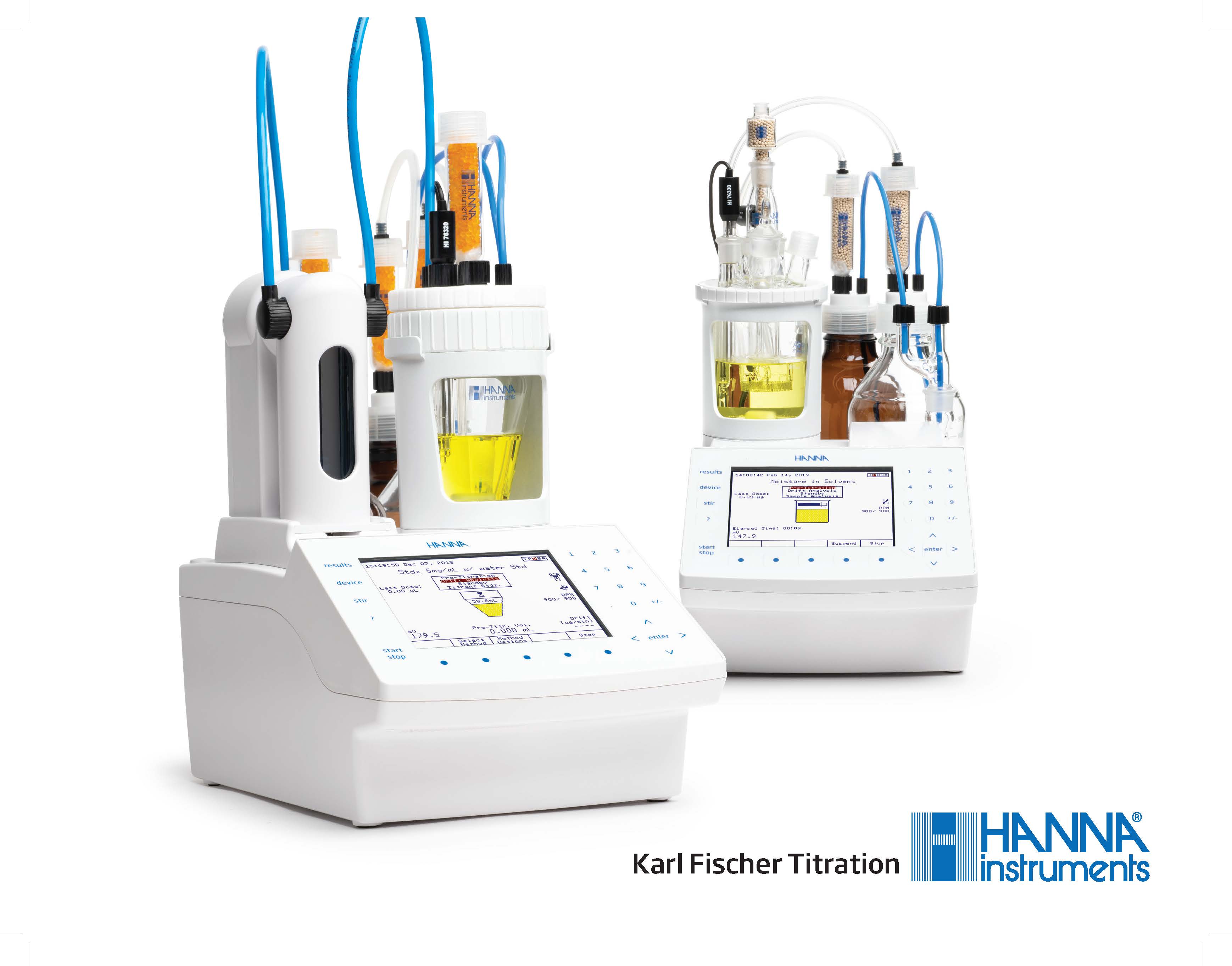
HI93x – Hanna Instruments Karl Fischer Titratoren
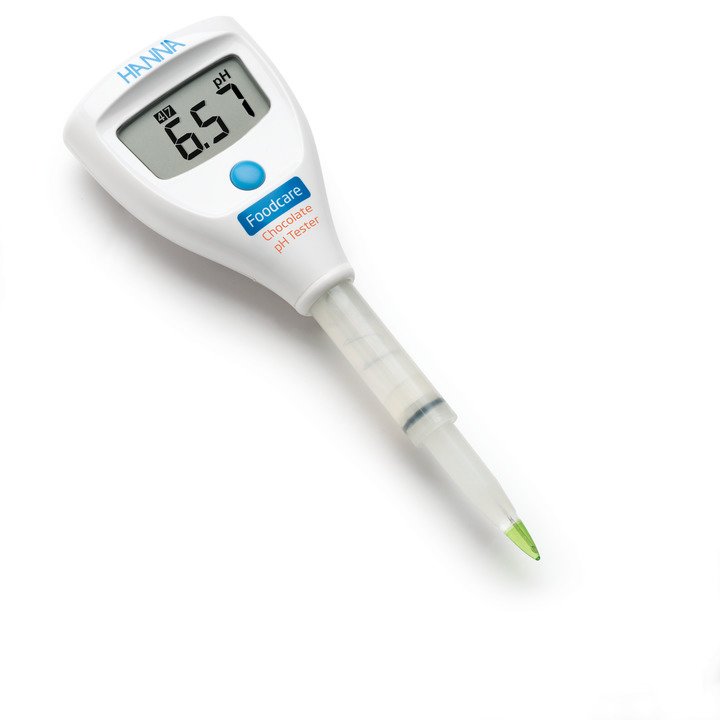
HI98103x-Serie um zwei Tester erweitert
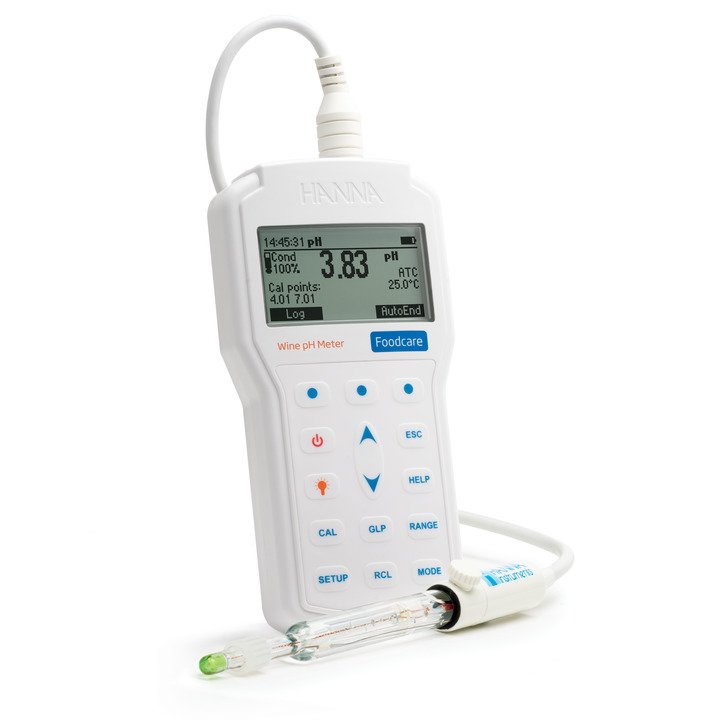
HI98169 Foodcare-pH-Meter für die Weinanalyse

Kontrolle wichtiger Wasserparameter in geschlossenen und offenen Kühlkreisläufen

Moderne Messtechnik für die Lebensmittelsicherheit

Neues für die Pool-Branche

Photometer-Serie HI97xxx erweitert

Refraktometrische Wassergehaltsbestimmung in Honig

Relevante Parameter im Abwasser bestimmen

Abwassereinigung und Messung wichtiger chemischer Parameter im Klärwerk

Bestimmung der Alkalinität in Wasser durch Titration

Chemischer Sauerstoffbedarf in Abwässern mit hoher Trübung

Das HI98494 Portables Multiparameter- pH/EC/OPDO®-Messgerät mit Bluetooth®-Technologie

Den Säuregehalt mit HI931 in Fruchtsaft bestimmen

Der Biochemische Sauerstoffbedarf (BSB) – ein Wert zur Beurteilung der Effizienz der Abwasserbehandlung

Die Bedeutung der Wasserqualität bei der Haltung von Zebrabärblingen für die Forschung

Die Bestimmung von CSB in Abwasser

Genaue Leitfähigkeits-Bodenuntersuchungen leicht gemacht

Hefe-assimilierbarer Stickstoff (YAN) – essenzieller Hefenährstoff für gesunde Weingärungen

HI780 Checker® HC pH in Meerwasser
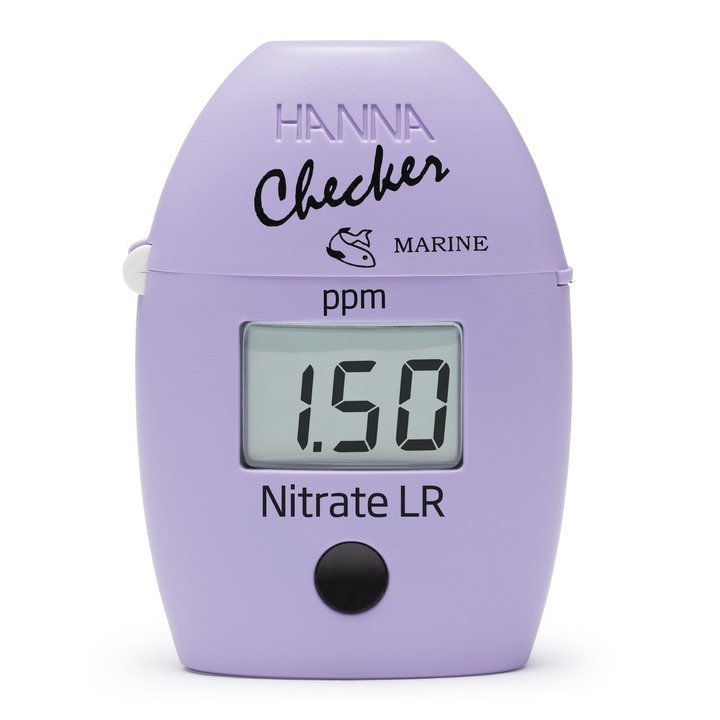
HI781 Checker® HC Nitrat in Meerwasser

Nitrat in Meerwasser mit dem HI781 richtig bestimmen

pH-Wert und gelöster Sauerstoff im Abwasser-Belebungsbecken

Überwachung der Nitratauswaschung aus gedüngten Böden

Überwachung und Steuerung des pH-Wertes von Industrieabwasser

Wenn es blitzsauber sein muss - Wirkung und Bestimmung von Desinfektionsmitteln

Zuckergehalt von Fruchtsäften refraktometrisch bestimmen

„Nitritpeak“ in Aquarien erkennen und Schäden vorbeugen

Cyanursäure in Schwimmbadwasser messen

Konzentration ist alles - die Wirksamkeit von Natriumhypchloritlösungen refraktometrisch bestimmen

Phosphorwerte im Riffaquarium ermitteln

Warum Alkalinität und Calcium in Riffaquarien besonders wichtig sind

Das Redoxpotential - ein wichtiger Parameter bei der Pooldesinfektion

Der pH-Wert im Pool - das A und O für die Wasserqualität

Haut-pH-Wert messen leicht gemacht

HI782 Checker® HC Nitrat im Meerwasser, hoher Messbereich

HIREEF-2 | Das Rundum-Sorglos-Paket für Ihr Riffaquarium

Individuelle Kosmetik: Der pH-Wert macht's

Ionenkonzentration und Photometrie zur Wasserhärtebestimmung

pH-Wert-Messung von Hautpflegeprodukten leicht gemacht

Ascorbinsäure (Vitamin C) und photometrische Titration

Das HI97105 Photometer für Meerwasser-Aquaristik

Die Alkalinität bei der Wasseraufbereitung

Die Bedeutung des pH-Werts beim Bierbrauen

Die Leitfähigkeit von Joghurt

Die Leitfähigkeit von Umkehrosmosewasser

Die verschiedenen Arten von Phosphor und womit Sie sie messen können

FAQ - Die 8 häufigsten Fragen zu Ihrem Multiparameter-Messgerät
Gesamtchlor und Freies Chlor – was ist eigentlich der Unterschied?

HALO2 mit Bluetooth® Smart-Technologie

Manuelle oder automatische Titration? Ein ehrlicher Vergleich

Mehr als nur Testkits - pH-Wert & Desinfektion in Pools bestimmen & regeln

Monitor für Meerwasseraquarien
Standardisierung von Titranten für die genaue Karl-Fischer-Titration

Tipps zur pH-Wert-Messung, -Kalibrierung und Elektrodenpflege

Titrierbare Gesamtsäure in Wein messen

Temperaturüberwachung bei Lagerung und Transport von Fleisch

Wasserqualität von Fischgewässern - Teil 2: Sauerstoff

Wasserqualität von Fischgewässern - Teil 3: Elektrische Leitfähigkeit

Wasserqualität von Fischgewässern - Teil 1: pH-Wert

10 Best Practices für Ihre volumetrische Karl-Fischer-Titration

Ionenkonzentration und Photometrie zur Wasserhärtebestimmung
Gesamthärte von Wasser wird durch Titration bestimmt. Dabei kann die Messung mittels einer ionenselektiven oder einer photometrischen Elektrode erfolgen.
Was bedeutet eigentlich "Wasserhärte"?
Bereits in der Antike unterschied man zwischen „hartem“ und „weichen“ Wasser. So bezeichnete schon Hippokrates Wasser, „das beim Trinken die Zunge und beim Waschen den Körper beißt“[1], als „hart“; Wasser, das diese Eigenschaften nicht aufwies, galt als "weich". Doch was verbirgt sich eigentlich hinter diesen Begriffen?
Der Begriff "Wasserhärte" bezeichnet in der angewandten Chemie die Stoffmengenkonzentration der im Wasser gelösten Ionen der Erdalkalimetalle und bestimmten Anionen, die sich mit ihnen verbinden. Zu den sogenannten „Härtebildnern“ gehören in erster Linie Calcium- und Magnesiumionen. Strontium- und Bariumionen spielen bei der Härtebildung nur eine untergeordnete Rolle, da sie normalerweise nur in Spuren im Wasser vorhanden sind.
Die Wasserhärte entsteht beim Durchtritt von Wasser durch carbonathaltige Böden und Gesteine (z.B. durch Kalk (Calciumcarbonat, CaCO3) oder Dolomit (Mischcarbonat aus Calcium und Magnesium)). Treffen Niederschläge auf Kohlenstoffdioxid (CO2) in der Luft, wird dieses zum größten Teil physikalisch im Wasser gelöst. Während Carbonate in reinem Wasser kaum löslich sind (die Löslichkeit von Calciumcarbonat beträgt 14 Milligramm pro Liter), steigt bei Anwesenheit von gelöstem Kohlenstoffdioxid die Löslichkeit jedoch um das Hundertfache. Es bilden sich zunächst Hydrogencarbonate (HCO3-):
C a C O 3 + C O 2 + H 2 O ⇌ C a 2 + + 2 H C O 3 −
M g C O 3 + C O 2 + H 2 O ⇌ M g 2 + + 2 H C O 3 -
Ein kleiner Teil des CO2 in der Luft bildet mit dem Wasser aber auch Kohlensäure (H2CO3):
C O 2 + H 2 O ⇌ H 2 C O 3
Die gebildeten Hydrogencarbonate dissoziieren in Wasser zu Carbonat-Ionen (CO32-) und Oxonium-Ionen (H3O+) und stehen mit der Kohlensäure in einem Gleichgewicht:
H C O 3 − + H 2 O ⇌ C O 3 2 − + H 3 O +
H 2 C O 3 + H 2 O ⇌ H C O 3 − + H 3 O +
Die anwesenden Erdalkali-Ionen gehen unter Bildung von Kohlensäure mit den Carbonat-Ionen wieder eine Verbindung ein. Man spricht hierbei auch vom „Kalk-Kohlensäure-Gleichgewicht:
C a 2 + + 2 H C O 3 − ⇌ C a C O 3 + H 2 C O 3
Das Wasser befindet sich im Kalk-Kohlensäure-Gleichgewicht, wenn es gerade so viel Kohlenstoffdioxid enthält, dass Kalk weder ausgefällt noch gelöst wird. Durch verschiedene Einflüsse kann dieses Gleichgewicht jedoch auf die eine oder andere Seite verschoben werden. Eine große Rolle spielen z.B. der pH-Wert oder die Temperatur. Auch Verdunstung oder Verdünnung wirken sich auf die CO2-Konzentration aus und führen somit zu einer Gleichgewichtsverschiebung, wobei Calciumcarbonat entweder im Wasser gelöst oder ausgefällt wird. In Verbindung mit Magnesium können sich bei der Ausfällung auch schwer lösliche Mischkarbonate bilden („Dolomit“).
Auswirkungen von hartem oder weichem Wasser

In Gebieten mit hoher Leitungswasserhärte bemerkt man die Anzeichen dafür bereits im Alltag. Bezeichnend für die Anwesenheit gelöster Härtebildner ist die Bildung von in Wasser schwer löslichen Verbindungen. Hierzu zählen vor allem Carbonate und Dolomite, die zu Kalkablagerungen führen, und sogenannte Kalkseifen, die anionische Tenside binden und somit z.B. zu einem höheren Waschmittelverbrauch führen. Kalkflecken auf Oberflächen, Kalkablagerungen (Kesselstein) in Heizanlagen, Wasserleitungen und Haushaltsgeräten, verkalkte Wasserhähne, Geschmacksbeeinträchtigungen beim Genuss von mit hartem Wasser zubereitetem Kaffee oder Tee, sind nur einige der Gelegenheiten, bei denen sich eine hohe Wasserhärte bemerkbar macht. Andererseits kann aber auch zu weiches Wasser durch seine Fähigkeit, Mineralien zu lösen, zu Problemen führen. Man spricht hierbei von "aggressivem Wasser", das Leitungen und Baustoffe angreifen und für Korrosion sorgen kann.
Wasserhärte-Einheiten
Der Einfluss der Wasserhärte auf die verschiedensten Anwendungsbereiche hat dazu geführt, dass man weltweit Systeme entwickelt hat, um sie zu beschreiben und einzuordnen. Dabei sind international unterschiedliche Einheiten entstanden, die auch heute noch in vielen Bereichen benutzt werden. Das nach dem SI-Maßsystem korrekte Maß für die Gesamtwasserhärte ist jedoch der Gesamtgehalt der Erdalkali-Ionen in Millimol pro Liter (mmol/L). Ab 2007 gilt in Deutschland seit einer Neufassung des Wasch- und Reinigungsmittelgesetzes die Einheit von mmol/L CaCO3.
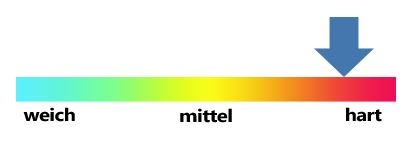
Die über die Jahre entstandenen Bezeichnungen und Einordnungen der Wasserhärte in z.B. „Grad deutscher Härte" (°dH) sind somit eigentlich veraltet, halten sich jedoch weiterhin in der alltäglichen Verwendung. Daher werden die Wasserhärtewerte auch nach wie vor von den Wasserversorgungsunternehmen in diesen Einheiten zur Verfügung gestellt. bzw. in der Literatur verwendet. Tabelle 1 zeigt die seit 2007 in Deutschland übliche Einordung der Gesamtwasserhärte in deutsche Härtegrade und ihre Entsprechung in mmol/L CaCO3 und anderen internationalen Einheiten.
Tabelle 1: Einteilung der Gesamtwasserhärte
|
Härtebereich |
mmol/L CaCO3 |
°dH (Deutschland) |
ppm CaCO3 (USA) |
°fH |
°e |
|
weich |
< 1,5 |
< 8,4 |
Weniger als 150 |
15,0 |
< 10,5 |
|
mittel |
1,5 bis 2,5 |
8,4 bis 14 |
150 bis 249 |
15,0 bis 24,9 |
10,5 bis 17,4 |
|
hart |
> 2,5 |
> 14 |
> 249 |
> 24,9 |
> 17,4 |
Bei der Verwendung des Begriffs „Wasserhärte“ ist weiterhin zu beachten, dass zwischen der „Gesamthärte“, der „Karbonathärte“ und der „Nichtkarbonathärte“ unterschieden wird:
- Die Gesamthärte umfasst alle gelösten Erdalkalimetalle und deren Verbindungspartner (Carbonate, Sulfate, Chloride, Nitrite, Nitrate und Phosphate).
- Die Karbonathärte bezeichnet nur die Menge der Erdalkalimetalle, die als Carbonate vorliegen, bzw. umfasst als "Alkalität" die Carbonate und die aus dem Kohlensäuregleichgewicht gebildeten Hydrogencarbonate. Die Karbonathärte spielt für den pH-Wert und die Pufferkapazität des Wassers eine große Rolle. Mehr dazu finden Sie in unserem Artikel zur Alkalinität.
- Die Nichtkarbonathärte ist schließlich die Differenz aus diesen beiden Werten, bezeichnet also alle Erdalkalimetalle, die als Sulfat, Chlorid, Nitrit, Nitrat und Phosphat vorliegen.
Wie wird die Wasserhärte bestimmt?
Für den privaten Bereich ist es oft ausreichend, die Wasserhärtewerte des Leitungswassers beim örtlichen Wasserversorger zu erfragen, denn das in das in das Trinkwassersystem eingespeiste Wasser wird regelmäßig kontrolliert und die Ergebnisse werden veröffentlicht. Für bestimmte Anwendungen kann es jedoch nötig sein, die Wasserhärte genauer zu bestimmen, z. B. bei der Unterhaltung eines Pools oder in der Aquaristik.
Bei der Prüfung der Wasserhärte werden ausschließlich Calcium- und Magnesium bestimmt, da dies die beiden Erdalkalimetalle sind, welche die Gesamthärte des Wassers maßgeblich beeinflussen. Die Ergebnisse für die Härte werden als mmol/L CaCO3 ausgedrückt, was der Gesamtmenge an Calcium und Magnesium in einem Liter Wasser entspricht. In amerikanischen Systemen wird der Wert in ppm CaCO3 ausgedrückt (1 mmol/L CaCO3 = 0,056 ppm CaCO3)
Die Standardmethode, die Wasserhärte zu bestimmen, ist die Titration, wobei Calcium- und Magnesium-Ionen mit dem Titranten EDTA (Ethylendiamintetraessigsäure) Komplexe bilden. Durch die Bestimmung der zugegebenen Menge des Titranten bis zum Äquivalenzpunkt* kann dann die Konzentration dieser beiden Ionen berechnet werden.
Dieses Prinzip wird auch bei einfachen, chemischen Testkits zur Bestimmung der Wasserhärte im Privatbereich angewandt. Hier wird der Probe ebenfalls EDTA per Tropfflasche zugegeben und die dosierte Menge wird mit Hilfe eines Farbindikators bestimmt (in diesem Fall durch "Tropfenzählen"). Für Labor- und Industrieanwendungen ist diese Methode selbstverständlich zu ungenau, weshalb in diesen Bereichen eine (automatisierte) präzisere Titration bevorzugt wird. Diese kann auf zwei verschiedene Weisen erfolgen:
1. mit einer Ionensensitiven Elektrode (ISE) für Calcium oder
2. mit einer photometrischen Elektrode.
Die Verwendung des einen oder anderen Verfahrens hängt von der allgemeinen Zielsetzung der Messung und der Präferenz des Anwenders ab, wobei beide Methoden ihre Vor- und Nachteile haben (s. Tabelle 2).
Tabelle 2: Vor- und Nachteile der Härtebestimmung mit einer ISE und einer photometrischen Elektrode.
|
Vorteile |
Calcium ISE |
Photometrische Elektrode |
|
Bestimmung von Calcium und Magnesium in einer Titration (1 Probe) |
Minimaler Wartungsaufwand für die Elektrode |
|
|
Kaum Abweichungen gegenüber der manuellen Titrationsmethode |
||
|
Nachteile
|
Höhere Wartungsaufwand für die Elektrode |
Für Calcium und Magnesium ist jeweils eine eigene Titration erforderlich (2 Proben). |
|
Höhere Anschaffungs- und laufende Kosten (ISE und erforderliche Chemikalien) |
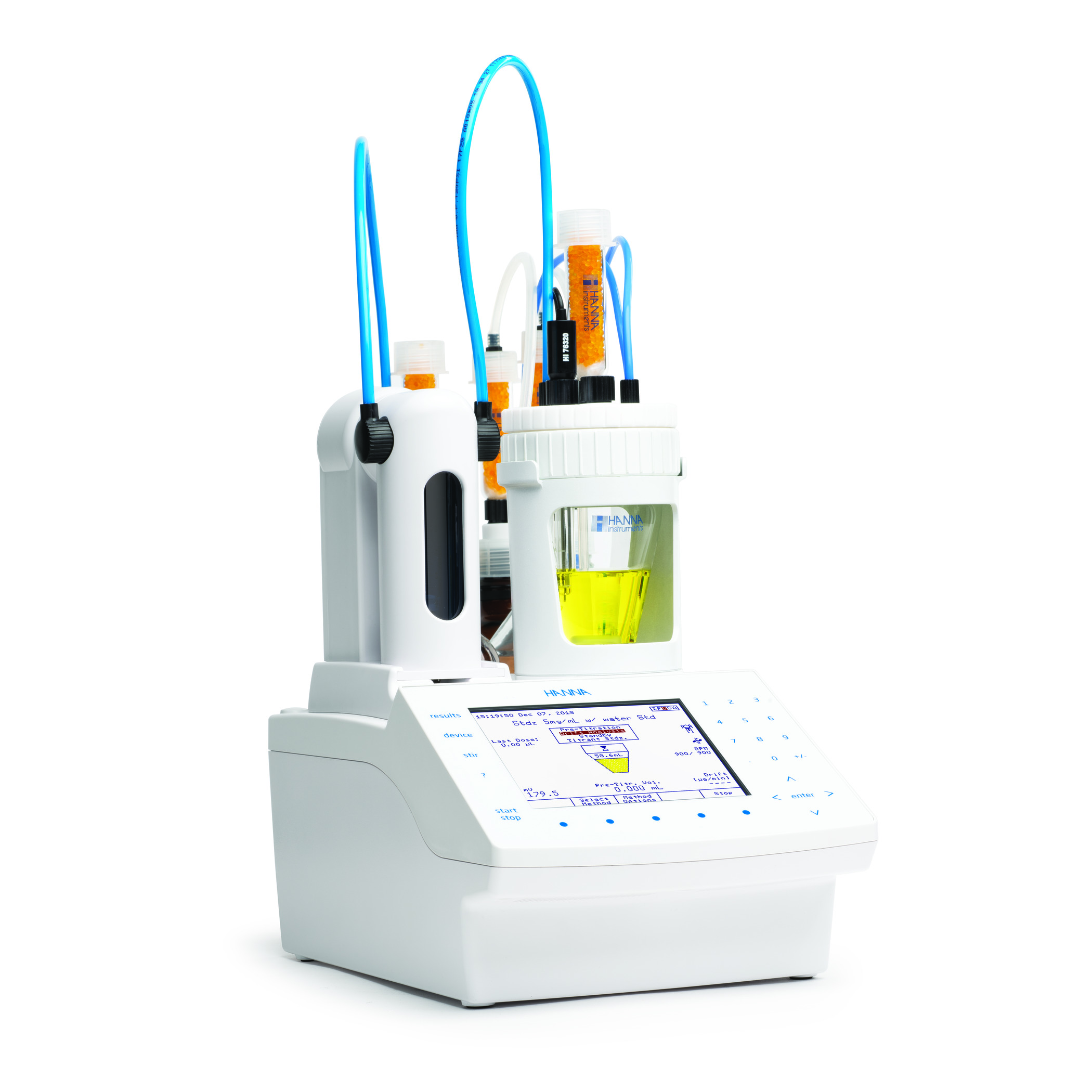
Titration mit der ionenselektiven Elektrode für Calcium, HI4104
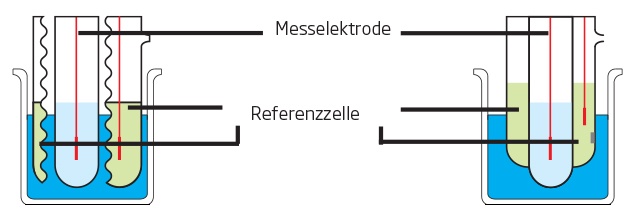
 Zusammen mit TRIS-Puffer kann die Calcium-ISE verwendet werden, um sowohl Calcium als auch Magnesium in einer Titration zu erfassen, wobei jedes Ion unterschieden und als eigener spezifischer Äquivalenzpunkt angezeigt wird (s. Abbildung 1). Nach Abschluss der Titration werden die Ergebnisse automatisch für die Gesamthärte, die Calciumhärte und die Magnesiumhärte berechnet. Dadurch kann eine Probe für alle drei Analyten verwendet werden, was Anwendern mit einem hohen Probendurchsatz zugute kommt. Allerdings erfordert diese Methode etwas höhere Anschaffungs- und laufende Kosten für notwendige Materialien und Verbrauchsmaterialien. Außerdem erfordert die ISE mehr Zeit für die Elektrodenvorbereitung und -wartung, was eine steilere Lernkurve für diejenigen bedeutet, die mit ionenselektiven Elektroden nicht vertraut sind.
Zusammen mit TRIS-Puffer kann die Calcium-ISE verwendet werden, um sowohl Calcium als auch Magnesium in einer Titration zu erfassen, wobei jedes Ion unterschieden und als eigener spezifischer Äquivalenzpunkt angezeigt wird (s. Abbildung 1). Nach Abschluss der Titration werden die Ergebnisse automatisch für die Gesamthärte, die Calciumhärte und die Magnesiumhärte berechnet. Dadurch kann eine Probe für alle drei Analyten verwendet werden, was Anwendern mit einem hohen Probendurchsatz zugute kommt. Allerdings erfordert diese Methode etwas höhere Anschaffungs- und laufende Kosten für notwendige Materialien und Verbrauchsmaterialien. Außerdem erfordert die ISE mehr Zeit für die Elektrodenvorbereitung und -wartung, was eine steilere Lernkurve für diejenigen bedeutet, die mit ionenselektiven Elektroden nicht vertraut sind.
Abb. 1: Titration mit zwei Äquivalenzpunkten (EQPT) mittels Calcium-ISE-Methode, wobei sich EQPT 1 (7,528 mL) auf die Calciumhärte und EQPT 2 (1,682 mL) auf die Magnesiumhärte bezieht.

Mehr zur Calcium-ISE (mit einem Beispiel im Anwendungsbereich Lebensmittel) finden Sie auch in diesem Artikel.
Titration mit der photometrischen Elektrode HI900601
 Die Gesamthärte und die Calciumhärte können mit einem Farbindikator bestimmt werden[2], wobei die Magnesiumhärte durch Subtraktion berechnet wird:
Die Gesamthärte und die Calciumhärte können mit einem Farbindikator bestimmt werden[2], wobei die Magnesiumhärte durch Subtraktion berechnet wird:
Magnesiumhärte = Gesamthärte (Titration #1) – Calciumhärte (Titration #2)
Der Indikatorfarbstoff sorgt für einen Farbumschlag in der Probe und signalisiert damit das Ende der Titration. Indikatorfarbstoffe können nicht nur bei einer manuellen Härtetitration verwendet werden, sondern kommen auch bei der automatischen Titration unter Verwendung einer photometrischen Elektrode zum Einsatz. Während manuelle Titrationen oft durch menschliche Fehler beeinflusst werden (aufgrund der subjektiven Bestimmung des Farbendpunkts), entfällt diese Subjektivität bei automatischen Titrationen durch die Verwendung einer Elektrode zur Erkennung des Farbwechsels. Für die Bestimmung der Wasserhärte wird die photometrische Elektrode HI900601 für die Wellenlänge von 525 nm verwendet.
Unsere applikationsbasierten photometrischen Elektroden der Serie HI90060x sind für vier verschiedene Wellenlängen erhältlich. So kann die für die jeweilige Anwendung spezifisch geeignete Elektrode gewählt werden, was die Anschaffungskosten gegenüber einer photometrischen Elektrode für mehrere Wellenlängen deutlich reduziert. Photometrische Elektroden erfordern nur minimale Wartung und senken die laufenden Kosten erheblich. Methoden, Verfahren, und Chemikalien einer bisher angewandten Titration können nach wie vor verwendet werden. Um alle Härtebildner mit dieser Methodik zu bestimmen, sind jedoch zwei separate Titrationen (und damit zwei separate Proben) erforderlich. Dies sollte bei einem hohen Probendurchsatz oder Einschränkungen durch geringes Probenvolumen berücksichtigt werden.
Weitere Informationen zu unseren Photometrischen Elektroden HI9960x finden Sie hier.
* Äquivalenzpunkt: bezeichnet den Endpunkt der Titration, an dem die dem Gehalt der zu bestimmenden Substanz äquivalente Menge Titrant hinzugefügt wurde.
Quellen:
- https://de.wikipedia.org/wiki/Wasserhärte
- [1] Anne Liewert: Die meteorologische Medizin des Corpus Hippocraticum. De Gruyter, Berlin/München/Boston 2015, ISBN 978-3-11-041699-2
- [2] Standard Methods for the Examination of Water and Wastewater Methods 2340 C. and 3500-Ca D., EDTA Titrimetric Method
Dieser Beitrag verwendet in Auszügen Übersetzungen des Artikels „Titrating for Water Hardness is Made Easy with Photometric Electrodes“ von Amanda Trainer, Hanna Instruments, USA.
Aus Gründen der sprachlichen Vereinfachung wird auf die Nennung der Geschlechter verzichtet, wo eine geschlechtsneutrale Formulierung nicht möglich ist. In diesen Fällen beziehen die verwendeten männlichen Begriffe die weiblichen Formen ebenso mit ein.
Haben Sie Fragen oder Anregungen?
Haben Sie noch Fragen oder Anregungen zum Artikel, zu den Produkten oder ganz allgemein? Kontaktieren Sie uns über unser Kontaktformular, schreiben Sie uns eine E-Mail oder besuchen Sie uns auf unseren Seiten in den sozialen Medien. Unsere Mitarbeiter sind gern für Sie da.
Zugehörige Produkte





